Ингибиторы PARP — современная группа таргетных противоопухолевых препаратов, которые блокируют ферменты поли(АДФ-рибоза)-полимеразы (poly(ADP-ribose) polymerase, сокращенно PARP). Эти ферменты участвуют в репарации поврежденной ДНК. Под действием ингибиторов PARP этот процесс нарушается, в генах возникают критические повреждения, и опухолевые клетки погибают.
Фактически вещества, обладающие свойствами ингибиторов PARP, были открыты еще в 1971 году. Но они оказались не очень эффективными и вызвали слишком много побочных эффектов. Первый препарат, одобренный американским управлением FDA, вошел в клиническую практику только в 2014 году. В настоящее время ингибиторы PARP применяются для лечения рака яичников и маточных труб, молочной железы, простаты, поджелудочной железы и злокачественных опухолей брюшины. Кроме того, ведутся клинические испытания, чтобы проверить, насколько эти препараты эффективны при других онкологических заболеваниях.
Интеллектуальная собственность https://www.euroonco.ru
Какие функции выполняет белок PARP, и почему он важен для раковых клеток?
PARP — это семейство белков-ферментов, которые выполняют в клетках различные функции. Они участвуют в регуляции преобразовании структуры хромосом, транскрипции (перенос генетической информации с ДНК на РНК, чтобы в дальнейшем синтезировался белок), репликации (удвоении ДНК), рекомбинации (обмен участками ДНК между хромосомами), репарации («починке») поврежденной ДНК. Именно последняя функция в этом списке сильнее всего интересует ученых, которые занимаются разработкой противоопухолевых препаратов.
Семейство PARP включает 18 белков. Лучше всего изучен PARP-1. Впервые упоминания о нем в научной литературе появились еще в 1963 году. В 1980 году ученые предположили, что, влияя на PARP-1, можно повысить эффективность некоторых химиопрепаратов.
Несмотря на то, что ДНК во время деления клеток в теле человека копируется с высокой точностью, периодически возникают ошибки, поломки. На этот случай природой предусмотрены специальные системы репарации поврежденного генетического материала. У человека работает шесть таких систем:
- Эксцизионная репарация оснований (base excision repair, BER) — устранение неправильных отдельных «букв» генетического кода или коротких участков ДНК, состоящих из нескольких букв.
- Эксцизионная репарация нуклеотидов (nucleotide Excision Repair, NER) — исправление более длинных поврежденных участков ДНК. Эта система «вырезает» неправильный участок в одной цепочке ДНК, а затем синтезирует его снова на матрице второй цепочки.
- Репарация однонитевых разрывов (single-strand break repair, SSBR) — «сшивание» ДНК, в одной из двух цепочек которой произошел разрыв.
- Репарация путем гомологичной рекомбинации (homologous recombination, HR) — метод починки ДНК, в которой разорвались обе цепочки. Все хромосомы в клетках человека представлены двумя копиями. Когда в одной из них происходит двухцепочечный разрыв, она использует свою «сестру» как шаблон, чтобы восстановить генетический материал.
- Негомологичное соединение концов (non-homologous end joining, NHEJ) — механизм, который просто соединяет концы ДНК при двухцепочечных разрывах, без гомологичной рекомбинации. Это менее точный метод репарации, после него могут теряться некоторые «буквы» генетического кода, возникать другие нарушения.
- Репарация ошибочно спаренных нуклеотидов (мисмэтч репарация, mismatch repair — MMR) — система, которая находит и устраняет несоответствия в генетическом коде.
Ферменты PARP-1 и PARP-2 играют важную роль в первом из перечисленных путей — эксцизионной репарации оснований. Белок PARP умеет обнаруживать разрыв одной цепочки ДНК, прикрепляется к ней в этом месте и заставляет работать другие ферменты репарации. Но этот процесс требует затрат энергии. Если PARP-1 активируется слишком сильно, например, при выраженных повреждениях ДНК и во время кислородного голодания, то энергетические ресурсы клетки истощаются, и она погибает.
Кроме того, существуют доказательства, что PARP принимают участие в восстановлении ДНК при разрыве обеих ее цепочек.
Как работают ингибиторы PARP?
При раке нередко возникают мутации в генах, которые кодируют белки, отвечающие за репарацию ДНК. Если в раковых клетках перестает работать хотя бы одна из шести систем репарации — эта особенность становится их ахиллесовой пятой. Стоит заблокировать еще один путь репарации с помощью лекарств — и повреждения ДНК достигают критического уровня, опухолевая клетка погибает. На этом и основано применение препаратов из группы ингибиторов PARP.
В 2005 году появились первые сообщения о том, что подавление функции PARP в клетках с мутациями в генах BRCA приводит к их гибели. Гены BRCA1 и BRCA2 кодируют белки, которые играют важную роль в пути репарации ДНК под номером 4 в нашем списке: репарации путем гомологичной рекомбинации. Если в этих генах возникают мутации (они бывают наследственными и приобретенными), то восстановление ДНК нарушается. С одной стороны, из-за этого в нормальной клетке накапливаются мутации, которые могут превратить ее в раковую. В то же время, если в раковых клетках заблокировать еще один путь репарации, то мутации накапливаются еще быстрее и становятся смертельными для клетки.
В настоящее время считается, что ингибиторы PARP работают против рака именно так — подавляют репарацию ДНК. В итоге одноцепочечные разрывы сохраняются, превращаются в двухцепочечные, а они тоже не устраняются, потому что не работает система гомологичной рекомбинации из-за мутации в гене BRCA.
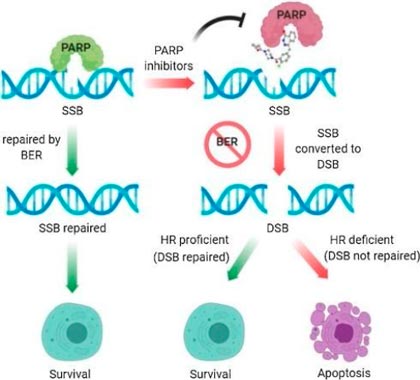
Известны два механизма, с помощью которых могут работать ингибиторы PARP:
- связываются с ферментом PARP и блокируют его активность;
- вмешиваются, когда фермент уже соединился с ДНК, и переводят его в неактивную форму.
При каких злокачественных опухолях применяют ингибиторы PARP?
С появлением ингибиторов PARP наступила новая эра в лечении рецидивирующего и распространенного рака яичников. В первую очередь речь идет о злокачественных опухолях с наследственными и соматическими (приобретенными) мутациями в генах BRCA, так как в них уже есть одна поломка механизмов репарации ДНК.
Также ингибиторы PARP были одобрены и успешно применяются при следующих злокачественных опухолях:
- рак маточных труб;
- первичный рак брюшины;
- рак молочной железы;
- рак предстательной железы.
Представители группы
Олапариб (Линпарза) стал первым препаратом из группы ингибиторов PARP, зарегистрированным в 2014 году американским управлением FDA и Европейским агентством по лекарственным средствам (EMA). Изначально препарат был одобрен для лечения рака яичников с мутациями в генах BRCA. Со временем список показаний к его применению расширился. На данный момент он включает:
- рецидив рака яичников, маточных труб и первичных опухолей брюшины, если до этого наблюдался полный или частичный ответ на лечение химиопрепаратами из группы препаратов платины;
- распространенный рак яичников с мутациями в генах BRCA — в качестве лечения первой линии или после химиотерапии, самостоятельно или в сочетании с другими препаратами (бевацизумаб);
- HER2-отрицательный метастатический рак молочной железы с мутациями в генах BRCA, после курса химиотерапии;
- метастатический рак поджелудочной железы с мутациями в генах BRCA, если до этого как минимум в течение 16 недель заболевание не прогрессировало на фоне химиотерапии;
- кастрационно-резистентный рак предстательной железы с мутациями в генах гомологичной рекомбинации.
Рукапариб (Рубрака) во многом похож на олапариб. FDA разрешило его применение при раке яичников в рамках процедуры ускоренного одобрения лекарственных препаратов в 2016 году. В настоящее время его применяют при распространенном и рецидивирующем эпителиальном раке яичников, маточных труб и первичных злокачественных опухолях брюшины, чувствительных к препаратам платины и несущих мутации в генах BRCA. В 2020 году рукапариб был одобрен для лечения кастрационно-резистентного метастатического рака простаты с мутациями в генах BRCA.
Нирапариб (Зеджула) стал третьим препаратом из группы ингибиторов PARP, одобренных FDA. Он применяется на территории США и Европейского союза с 2017 года. Показанием к применению является лечение распространенного и рецидивирующего рака яичников, маточных труб и первичных опухолей брюшины, чувствительных к препаратам платины.
Талазопариб (Талценна) отличается от всех предыдущих препаратов тем, что он пока еще не одобрен для применения при раке яичников. Его используют при HER2-отрицательном метастатическом и местно-распространенном раке молочной железы с наследственными мутациями в генах BRCA. Талазопариб был одобрен FDA в 2018 году, регулирующими органами Европы — в 2019 году.
Возможные побочные эффекты
Таргетная терапия в целом переносится пациентами лучше, чем классическая химиотерапия. Тем не менее, таргетные препараты, в том числе ингибиторы PARP, тоже могут вызывать некоторые побочные эффекты. Наиболее распространенные из них:
- побочные эффекты, вызванные воздействием на красный костный мозг и уменьшением количества клеток крови: анемия, повышенная уязвимость к инфекциям, повышенная кровоточивость;
- тошнота;
- чувство усталости;
- диарея;
- расстройства пищеварения;
- изменение чувства вкуса;
- головные боли, головокружения;
- нарушение функции печени и почек.
Эти побочные эффекты возникают не у всех пациентов, зачастую они выражены не сильно. Чтобы вовремя обнаружить нарушения и принять необходимые меры, во время курса лечения периодически проводят контрольные обследования, пациентам назначают анализы крови.
Другая проблема — устойчивость злокачественной опухоли к ингибиторам PARP. Это явление возникает при любой противоопухолевой терапии. Препараты в первую очередь уничтожают «слабые» раковые клетки, но «сильные» выживают, в них возникают новые мутации, и со временем лекарство перестает на них действовать. Вопросы устойчивости к ингибиторам PARP в настоящее время активно изучаются. Известно, что опухолевые клетки приспосабливаются выживать в присутствии этих препаратов многими способами. Выделяют два основных механизма (хотя, есть и другие, менее изученные):
- восстановление репарации путем гомологичной рекомбинации, которая была «поломана» в результате мутаций в генах BRCA;
- стабилизация репликационной вилки — участка, в котором две цепочки ДНК рассоединяются, когда происходит ее удвоение.
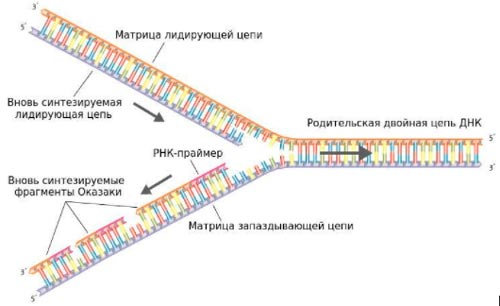
Так выглядит репликационная вилка. Справа находится исходная часть ДНК. Слева она разделилась на две цепочки, и на каждой из них синтезируется новая цепочка — из них образуются две новые молекулы ДНК. Стабилизации вилки репликации является одним из механизмов устойчивости раковых клеток к ингибиторам PARP.
При запущенном раке лечение ингибиторами PARP проводят до тех пор, пока не разовьется устойчивость, либо пока они не начнут вызывать серьезные побочные эффекты. В настоящее время ученые продолжают изучать механизмы развития резистентности рака к противоопухолевым препаратам, чтобы научиться профилактировать ее и повысить эффективность лечения.
Взгляд в будущее: перспективы применения ингибиторов PARP в онкологии
В настоящее время проводятся клинические исследования, в которых изучают эффективность ингибиторов PARP при раке легкого, поджелудочной железы, головы и шеи, желудка и пищевода, шейки матки, почек, мочевого пузыря, некоторых опухолях головного мозга. Кроме того, ведутся разработки новых препаратов из этой группы, некоторые из них уже завершили тестирование на животных и перешли на стадию клинических испытаний. Изучается эффективность и безопасность применения ингибиторов PARP в сочетании с химиопрепаратами, иммунопрепаратами.
Врачи федеральной сети клиник экспертной онкологии «Евроонко» постоянно отслеживают ход клинических испытаний. Мы оперативно узнаём о регистрации в России новых противоопухолевых препаратов, расширении показаний к применению уже зарегистрированных. В наших клиниках пациенты могут получить лечение всеми оригинальными противоопухолевыми препаратами новейших поколений в соответствии с актуальными версиями международных протоколов, рекомендациями авторитетных онкологических сообществ.
Список литературы:
- Feiyue Zheng, Yi Zhang, Shuang Chenc, Xiang Weng, Yuefeng Rao, Hongmei Fang. Mechanism and current progress of Poly ADP-ribose polymerase (PARP) inhibitors in the treatment of ovarian cancer. Biomedicine & Pharmacotherapy, Volume 123, March 2020, 109661.
- Alice Chen. PARP inhibitors: its role in treatment of cancer. Chin J Cancer. 2011 Jul; 30(7): 463–471.
- Julio C. Morales, Longshan Li, Farjana J. Fattah, Ying Dong, Erik A. Bey, Malina Patel, Jinming Gao, and David A. Boothman. Review of Poly (ADP-ribose) Polymerase (PARP) Mechanisms of Action and Rationale for Targeting in Cancer and Other Diseases.
- Esha Sachdev, Roya Tabatabai, Varun Roy, B J Rimel, Monica M Mita. PARP Inhibition in Cancer: An Update on Clinical Development. Target Oncol. 2019 Dec;14(6):657-679. doi: 10.1007/s11523-019-00680-2.
- Ming Yi, Bing Dong, Shuang Qin, Qian Chu, Kongming Wu & Suxia Luo. Advances and perspectives of PARP inhibitors.
- Румянцев А. А. Эволюция ингибиторов PARP: на какой ступени мы стоим? RosOncoWeb, новости онкологии.
- PARP inhibitors. Cancer Research UK.
- Guo-Min Li. Mechanisms and functions of DNA mismatch repair. Cell Res 18, 85–98 (2008). https://doi.org/10.1038/cr.2007.115
- olaparib (Rx). Medscape.
- ИНСТРУКЦИЯ по медицинскому применению лекарственного препарата Линпарза. АстраЗенека.
- Препарат олапариб зарегистрирован в США для лечения метастатического кастрационно-резистентного рака предстательной железы с мутацией в генах гомологичной рекомбинации. AstraZeneca.
- ЛИНПАРЗА (ОЛАПАРИБ) ОДОБРЕНА ДЛЯ ЛЕЧЕНИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С МУТАЦИЕЙ BRCA1/2. Качественная клиническая практика.
- rucaparib (Rx). Medscape.
- Rucaparib. U. S. Food & Drug Administration.
- With Two FDA Approvals, Prostate Cancer Treatment Enters the PARP Era. National Cancer Institute.
- niraparib (Rx). Medscape.
- FDA approves niraparib for first-line maintenance of advanced ovarian cancer. U. S. Food & Drug Administration.
- FDA approves talazoparib for gBRCAm HER2-negative locally advanced or metastatic breast cancer. U. S. Food & Drug Administration.































