В теле каждого человека есть клетки, в которых присутствуют мутации, способные привести к раку. Однако, эти изменения в ДНК реально приводят к злокачественным опухолям лишь в редких случаях. Почему же это происходит? Ученые до сих пор ищут ответ на этот вопрос.
Стандартное объяснение этого феномена состоит в следующем: для превращения нормальной клетки в злокачественную нужно, чтобы в ней накопилась определенная критическая масса мутаций. Однако, известно немало наблюдений, когда определенный набор генетических дефектов в одном случае приводит к развитию злокачественных опухолей, а в другом — нет.
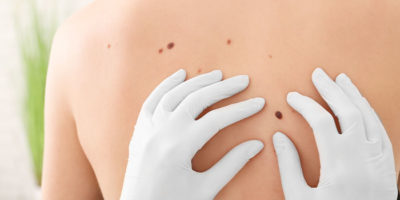
Наглядный пример — родинки. Эти доброкачественные новообразования состоят из клеток, которые не являются нормальными. Например, во многих присутствует мутация в гене BRAF. Если она появляется
Отчасти решить эту загадку удалось ученым из мемориального онкологического центра им.
Авторы работы обнаружили, что образование меланомы определяется так называемой «онкогенной компетенцией» — результатом сочетания набора генов, находящихся в конкретной клетке, и мутациями, возникшими в ее ДНК. Клетки меланомы используют гены, которые «молчат» в нормальных меланоцитах. Чтобы активировать эти гены, необходимы определенные белки, работающие как «ключи». Без них злокачественная опухоль не может образоваться, даже если в клетке присутствует весь соответствующий набор мутаций.
Интеллектуальная собственность https://www.euroonco.ru
Рыбы, люди и рак
Исследование, о котором идет речь, стало результатом научной работы, продолжавшейся около десяти лет. А началось всё намного раньше — когда один из авторов, доктор Уайт, еще начиная свой путь в науке, наблюдал развитие меланомы у рыбок
Доктор Уайт рассказывает:
Когда мы изучили меланомы у рыбок
данио-рерио , то обнаружили, что у них есть ряд активных генов, которые более характерны для эмбриональных клеток, чем для зрелых меланоцитов. Нам стало любопытно, почему эти гены активировались. Играют ли они роль в развитии меланомы, и если играют, то какую?
Чтобы разобраться, ученые вывели рыбок с мутантным геном BRAF, который присутствует не только во многих родинках, но и в половине случаев при меланоме. Причем, мутация была вызвана таким образом, чтобы она активировалась на разных стадиях развития пигментных
- на стадии нервного гребня — NC;
- на стадии меланобластов — MB;
- на стадии меланоцитов — MC.
По мере прохождения этих стадий, меланоциты становятся всё более дифференцированными, то есть всё более специализированными, зрелыми. Затем мальков с мутациями оставили в аквариуме, они росли, а ученые наблюдали за развитием злокачественных опухолей.
Было обнаружено, что меланомы развились только у рыбок, у которых мутации в гене BRAF активировались на стадиях NC и MB. Если мутация активировалась на стадии MC, то у рыбок появлялись доброкачественные невусы.
Но результаты экспериментов на животных далеко не всегда можно применить к людям. Поэтому ученые воспроизвели свое наблюдение на плюрипотентных стволовых клетках человека, заставляя их созревать и превращаться в меланоциты. И были получены аналогичные результаты. При активации на стадиях NC и MB клетки становились злокачественными, а на стадии MC — становились похожи на клетки родинок.
Этот феномен и был назван «онкогенной компетенцией».
Что контролирует «онкогенную компетенцию»?
Обнаружив такую интересную особенность, ученые решили глубже исследовать ее механизмы. Молекулярное профилирование показало, что ключевую роль играет белок под названием ATAD2. Оказалось, что он активен в клетках NC и MB, но неактивен в клетках MC.
Полное название белка ATAD2 — фактор модификации хроматина. Он связывается с определенными участками хромосомы рядом с генами и способствует тому, что эти гены активируются, с них начинает считываться информация, и синтезируются закодированные в них белки. Такие изменения в геноме называются эпигенетическими — они не влияют на структуру генов, но меняют их активность.
Клетки с активным белком ATAD2 способны активировать набор генов, которые в норме работают только у эмбрионов. Ученые провели серию экспериментов, во время которых «включали» и «выключали» ATAD2 в разных клетках. И оказалось, что это действительно влияет на способность к злокачественному перерождению.
Эти наблюдения были подтверждены и анализом больших баз данных: MSK и Атласа генома рака. Там удалось найти информацию о том, что показатели выживаемости намного ниже среди пациентов с высоким уровнем этого белка.
Важны не только мутации, но и контекст
Авторы работы утверждают, что открыли новый механизм развития злокачественных опухолей, который противоречит классическим представлениям.
Доктор Уайт отмечает:
В течение нескольких десятилетий господствует концепция, согласно которой для возникновения злокачественной опухоли необходимы две разновидности мутаций: в протоонкогенах и
генах-супрессорах опухолей. Теперь у нас есть третья переменная — онкогенная компетентность, которая отвечает за реализацию возникших мутаций.
Это похоже на начало пожара: зажженная спичка может причинить больший ущерб деревянному дому, чем каменному.
Большую роль в исследовании сыграла технология применения плюрипотентных стволовых клеток человека. Можно выделить стволовые клетки из крови, а затем дать им созреть, параллельно вызывая различные мутации. Это помогает изучать действие многих противоопухолевых препаратов.
Подобные фундаментальные исследования помогают не только изучить биологию рака, но и понять, как с ним лучше бороться. Это основа для создания новых более эффективных противоопухолевых препаратов, подходов к лечению. Мы в «Евроонко» внимательно следим за ходом клинических исследований, и как только новый препарат проходит регистрацию в России — сразу начинаем его применять. Наши пациенты получают лечение по самым современным стандартам, на уровне лучших онкологических центров Европы, Израиля, США.
Источник: sciencedaily.com.
Читайте также:
круглосуточно
и событий клиники