Особенности операций
Какой объём операций может выполняться при местно-распространённом РМЖ? По нашему опыту это зависит преимущественно от исходного статуса болезни. «Снижение стадии» болезни в результате предоперационной терапии это временное явление, которое нужно вовремя использовать для выполнения последующих этапов лечения, в частности — операции. Опасным заблуждением является представление о том, что «снижение стадии» после эффективной системной терапии при отёчной форме болезни позволит выполнить органосохраняющую операцию.
Такие клинические признаки опухолевого поражения лимфатической системы кожи как отек кожи или внутрикожные сателлиты, определяемые при первом осмотре больной, диктуют необходимость выполнения мастэктомии с тотальным иссечением кожи даже в случаях полного клинического эффекта от предоперационной терапии. В случаях отсутствия исходного отека кожи и сателлитов возможны варианты сохранения кожи молочной железы, например, выполнение кожесохраняющей мастэктомии. При отсутствии исходного отека кожи, сателлитов и общих противопоказаний к органосохраняющим операциям, такие операции возможны при достаточном сокращении объёма опухоли.
Выполнение технологии биопсии сигнального лимфатического узла у больных местно-распространённым РМЖ пока находится в стадии методической разработки. В настоящее время нашим предложением остаётся выполнение подмышечной лимфаденэктомии I-III уровней во всех случаях местно-распространённого РМЖ.
Таблица 12: объём операции на молочной железе при местно-распространённом раке.
| Исходный статус | Статус после терапии | Объём операции на молочной железе | |||
| Резекция | Кожесохра- няющая мастэктомия | Мастэктомия без тоталь- ного удале- ния кожи | Мастэктомия с тотальным удалением кожи | ||
| T4N0-3M0 Имеется отёк кожи и/или сателлиты |
Уменьшение или исчезновение проявлений болезни | - | - | - | + |
| T0-2N2M0, T3N1-2M0, T4N0-2M0, T0-4N3M0 Отсутствуют отёк кожи и сателлиты, наличие мультицентричности или внутриорганных метастазов, или значительного внутрипротокового распространения |
Уменьшение или исчезновение проявлений болезни | - | + | + | - |
| T0-2N2M0, T3N1-2M0, T4N0-2M0, T0-4N3M0 Отсутствуют отёк кожи, сателлиты, мультицентричность, внутриорганные метастазы и значительное внутрипротоковое распространение |
Уменьшение или исчезновение проявлений болезни | + | + | + | - |
Является ли первичная реконструкция молочной железы безопасной при МРРМЖ? Этому было посвящено наше ретроспективное исследование результатов операций, выполненных в 1992-2002 гг. Его рабочая гипотеза была основана на опасениях того, что «избыточный объем операции может активировать „спящие“ опухолевые клетки, снизить иммунитет, и, как результат, — спровоцировать рецидив болезни». Сравниваемые группы включали больных, которым выполнялась модифицированная радикальная мастэктомия с первичной реконструкцией молочной железы (124 больные) или выполнялись операции без первичной реконструкции (n=379). Группы равноценны по частоте основных клинических прогностических факторов. Примерно одну четвёртую в каждой из групп составляли больные МРРМЖ. Из-за опасности конфликта силиконового импланта с последующей лучевой терапией при МРРМЖ выполнялась реконструкция TRAM-лоскутом на двух мышечных ножках.
При средней длительности прослеженности равной 5 годам частота местного рецидива составила 1,6% в группе с первичной реконструкцией и 1,7% в группе модифицированной радикальной мастэктомии без реконструкции. Частота рецидива болезни в целом также не отличалась статистически значимо. Анализ факторов, влияющих на рецидив болезни, показывает преобладающее влияние таких известных факторов, как критерии T, N, возраст, проведение химиотерапии. Факт проведения первичной реконструкции не оказывал статистически значимого влияния на процесс рецидивирования опухоли. Таким образом, первичная реконструкция молочной железы может безопасно выполняться больным местно-распространённым РМЖ [75].
Однако, чем больше объем операций, тем вероятнее осложнения их заживления, особенно при сопутствующем сахарном диабете, ожирении и длительном курении. У этих больных длительное заживление раны может отсрочить проведение адъювантной ХТ, лучевой терапии. Поэтому для этой категории больных предпочтительнее отказ от первичной реконструкции.
Альтернативная тактика, то есть выполнение на первом этапе операции, не претендующей на радикализм (паллиативной операции), показана в случаях осложненного рака. Абсолютными показаниями к паллиативной мастэктомии являются кровотечение из распадающейся опухоли и абсцедирование опухоли. Относительные показания: распад опухоли, изъязвление. Паллиативную мастэктомию при этом желательно выполнять как радикальную, возможно выполнение операции по Холстеду. Это пример альтернативной тактики. Распад и кровотечение из опухоли создают другую ситуацию, в которой актуальным является лечение осложнения опухоли. Начало лечения с операции создает возможность для проведения лечения в полном объеме, химиотерапии и лучевой терапии (смотри рисунок 2).
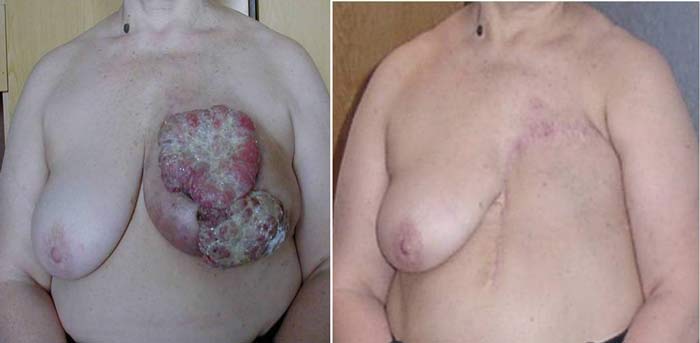
Рисунок 2. Больная местно-распространённым РМЖ, осложнённым распадом опухоли. До операции и через год после неё.
Некоторые прогностические факторы и адъювантная терапия
Ответ опухоли на неоадъювантную химиотерапию сам по себе является сильным фактором прогноза. По нашим данным, появление отдалённых метастазов зависело от клинической эффективности предоперационной ХТ. В первые два года метастазы возникали у 4% больных, леченных с эффектом; у 38% больных, леченных со стабилизацией; и у 100% больных, имевших местное прогрессирование опухоли [76]. По данным Kuerer HM, et al [77] степень выраженности морфологического эффекта от системной терапии также является очень сильным фактором прогноза. У больных РМЖ с ПМЭ и в молочной железе и в лимфатических узлах 5-летняя БРВ составила 87% — значительно больше, чем у больных с отсутствием ПМЭ (58%, p<0.01).
Guitu S. et al. представили ретроспективный анализ предоперационной ХТ больных РМЖ II-III стадий (n=461), проводившейся в Онкологическом центре Ж.-Ф.Леклерка (Дижон, Франция). 125 больных были с HER2-позитивными опухолями, половина из них получала предоперационно трастузумаб. Факторами, повышающими вероятность достижения ПМЭ, были Т (при Т1 более вероятно, чем при Т2, Т3 и Т4); степень злокачественности (при 2 степени злокачественности в 4,02; а при 3 в 9,99 раза более вероятно, чем при 1 степени); гистологическая форма (при дольковом раке примерно в 4 раза менее вероятно, чем при протоковом, относительная вероятность 0,23); молекулярный тип опухоли [при РЭ-РП-HER2- в 7,64; а при HER2+ в 11,17 раза вероятнее, чем при РЭ(+) и/или РП(+) опухолях], применение трастузумаба (в 8,77 раза вероятнее, чем без трастузумаба). Несмотря на низкую частоту ПМЭ при гормонально-зависимых раках [РЭ(+) и/или РП(+)], у этих больных наблюдалась самая большая продолжительность жизни без рецидива с медианой 9,0 лет, у больных с РЭ-РП-HER2- опухолями — 4,4 года, у больных с HER2-позитивными опухолями — 7,8 лет. В последней группе больных предоперационное применение трастузумаба ассоциировалось с более длительной продолжительностью жизни без рецидива, медиана — 8,65 года по сравнению с 3,24 года у больных, не получавших трастузумаб перед операцией (р=0,002). Медиана общей продолжительности жизни самая низкая при РЭ-РП-HER2- опухолях (6,4 года), при гормонально-зависимых опухолях — 13,1 года, при HER2-позитивных опухолях — 15,1 года (за счёт применения таргетных препаратов, 39).
В исследовании TECHNO (217 больных) отсутствие ПМЭ после ХТ, даже на фоне продолжающейся адъювантной терапии трастузумабом, было самым сильным фактором, достоверно повышающим вероятность рецидива болезни по сравнению с больными, достигшими ПМЭ (относительный риск 2,73); вторым по влиянию на безрецидивную выживаемость был критерий «Т» по системе TNM (при T4 относительный риск 2,06 по сравнению с больными, имевшими Т1-3). Факторами, влияющими на общую выживаемость, были (в порядке убывания значимости): возраст (старше 40 лет хуже, чем моложе 40 лет), наличие ПМЭ, Т, статус РЭ и РП [78].
Cortazar P. с соавт. провели метаанализ 12 рандомизированных исследований по неоадъювантной ХТ, число анализированных больных = 13125. Показано, что достижение полного морфологического эффекта, имеет большое позитивное прогностическое значение. Сочетание ПМЭ в молочной железе должно дополняться ПМЭ в лимфатических узлах, наличие остаточной опухоли в лимфатических узлах позитивный ослабевает прогностический эффект. Этого нельзя сказать об остаточной опухоли в молочной железе в виде внутрипротокового компонента, то есть, если выражаться символами системы TNM, ypT0ypN0 равноценно ypTisypN0. Достижение ПМЭ (ypT0/isypN0) улучшает БРВ (относительный риск=0.48) и ОВ (относительный риск =0.36) по сравнению с больными, у которых ПМЭ не достигнут. ПМЭ редко наблюдали у больных с опухолями низкой степени злокачественности и гормонально-позитивными (7%) и наиболее часто при следующих подтипах опухолей: высокой степени злокачественности и гормонально-позитивными (16%), тройными негативными (34%), гормонально-позитивными с HER2+ (30%), гормонально-негативными с HER2+ (50%). Чем более агрессивным был подтип опухоли, тем большим было различие БРВ между больными с ПМЭ и без него, относительный риск составил: для высокой степени злокачественности и гормонально-позитивных опухолей — 0.27; для гормонально-позитивных опухолей с HER2+ — 0.58; для гормонально-негативных с HER2+ — 0.25; для тройных негативных опухолей — 0.24. Влияние ПМЭ ограничивалось перечисленными вариантами РМЖ [79].
Tokudome N. et al. отмечают, что несмотря на более высокую частоту ПМЭ у больных с РЭ-РП-HER2- и HER2-позитивными опухолями, у них чаще развиваются метастазы в головной мозг, в том числе и у больных, имевших ПМЭ [80]. По данным S.P.Li et al. факторами, влияющими на отдалённые результаты у больных после предоперационной ХТ, являются уровень Ki67 в остаточной опухоли, состояние регионарных лимфатических узлов и экспрессия РП [81]. В наблюдении Tanei T. et al. самый лучший прогноз имели больные с ПМЭ после предоперационной ХТ, худший — больные с высокими значениями Ki67 в остаточной опухоли и промежуточный — больные с низкими значениями Ki67 в остаточной опухоли [82]. По мнению Wada N., et al. прогностическое значение Ki67 до предоперационной ХТ и после неё различно. Исходный уровень Ki67 — это фактор предсказывающий эффективность ХТ, при высоком исходном уровне Ki67 ПМЭ наблюдался в 23%, а при низком — в 9%. Уровень Ki67 в остаточной опухоли — фактор прогноза выживаемости, так, при высоком уровне Ki67 5-летняя выживаемость составила 51%, а при низком — 81% (р<0.01;83).
Интеллектуальная собственность https://www.euroonco.ru
Выводы
- Местно-распространённый рак молочной железы — «большая», системная и быстро метастазирующая болезнь. Обладает выраженной способностью к местно-регионарному рецидивированию.
- Наиболее успешная лечебная тактика слагается из предоперационной системной терапии, операции, лучевой терапии и адъювантной системной терапии.
- Дальнейшее улучшение результатов лечения возможно посредством повышения эффективности системной терапии.
- Органосохраняющие операции больным местно-распространённым раком молочной железы могут производиться при отсутствии признаков исходного опухолевого поражения лимфатической системы кожи (отёк, сателлиты) и других противопоказаний, после эффективной системной терапии.
- Наличие признаков исходного опухолевого поражения лимфатической системы кожи (отёк, сателлиты) молочной железы означает необходимость выполнения модифицированной радикальной мастэктомии после проведения эффективной системной терапии.
- Первичная реконструкция молочной железы больным местно-распространённым раком может производиться при отсутствии факторов, отягчающих заживление ран (сахарный диабет, ожирение, длительное курение).
- Рекомендуемый объём лимфаденэктомии при местно-распространённом раке молочной железы — I-III уровни.
- Выполнение паллиативной мастэктомии оправдано у больных с распадом опухоли и/или кровотечением из опухоли.
Источники литературы
- Портной С.М. Рак молочной железы (факторы прогноза и лечение). Дисс. д.м.н. М., 1997.
- Портной С.М. Функциональное состояние и заболевания печени у больных раком молочной железы. Дисс. к.м.н. М., 1981.
- Кутателадзе Т.О., Морошкин И.Б., Портной С.М. Динамика метастазирования рака молочной железы в костях. Советская медицина. — 1989. — № 11. — с. 16-19.
- Baillet F., Rozec C., Ucla L. et al. Treatment of locally advanced breast cancer without mastectomy: 5- and 10-yr results of 135 tumors larger than 5 cm treated by external-beam therapy, brachytherapy and neoadjuvant chemotherapy // Pisa Symposia in Oncology. Breast Cancer: From Biology to Therapy. October 19-21, 1992. Pisa, P. 22.
- McLaren D.B., Keen C.W., Webster D.W., Barrett-Lee P.J. 15 years of neoadjuvant chemotherapy in advanced carcinoma of the breast // Br. J. Cancer. 1995. Vol. 72, Suppl. 25 P. 4.
- Buric M., Filipovic S., Projevic M., Veselinovic S. Metastatic dissemination in the inflammatory breast cancer (IBC) // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-22.
- М.В.Шомова. Местнораспространенный рак молочной железы (лечение и факторы прогноза) Дисс. д.м.н., Москва, 1999.
- С.М.Портной, К.П.Лактионов, А.И.Барканов, и др. Опыт лечения больных прогностически отягощённым местно-распространённым раком молочной железы. IV ежегодная российская онкологическая конференция Москва,21-23 ноября 2000 г. Москва, 2000. С.57-59.
- Bristol IJ, Woodward WA, Strom EA, et al. Locoregional treatment outcomes after multimodality management of inflammatory breast cancer. Int J Radiat Oncol Biol Phys. 2008;72(2):474-84.
- Dawood S, Broglio K, Yang W-T, et al. Prognostic significance of HER2 status in women with inflammatory breast cancer. // 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM . December 13–16, 2007. Breast Cancer Research and Treatment VOL. 106. — Suppl. 1. — Abstr. 6005.
- Mehta RS, Schubbert T, Jackson D, et al. Pathologic complete response following paclitaxel (cremophor or albumin bound) + carboplatin ± trastuzumab± bevacizumab sequenced after in vivo chemosensitivity-adapted dose-dense doxorubicin-cyclophophamide in inflammatory breast cancer. // 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM. December 13–16, 2007. -Breast Cancer Research and Treatment. — 2007. -VOL. — 106. — Suppl. 1. — Abstr. 5066.
- Haagensen C., Stout A.P. Carcinoma of the breast. II — Criteria of operability. Ann. Surg. −1943. — 118. — 859-870 & 1032-1051.
- C.D.Haagensen. Diseases of the breast. W.B.Sauders Company. Philadelphia and London, 1956, 751 p.
- Haagensen C. Diseases of the breast. 1965.
- Гольдман Б.Г. Внутриартериальная регионарная химиотерапия в комплексном лечении местно распространённого рака молочной железы. Дисс. канд. мед. наук.1966.
- Гольдман Б.Г. Непосредственные результаты предоперационной химиотерапии рака молочной железы. // Вопросы онкологии. — 1975. — N 10. — С. 19-21.
- Викманис У.Э. Лечение первично распространённого рака молочной железы. Дисс. канд. мед. наук. М., 1975.
- Полевая Е.Б. Лечение распространённого рака молочной железы у молодых женщин. Тезисы симпозиума, Л. 1975. С. 95-96.
- Соколова И.Г. Предоперационная полихимиотерапия в комплексном лечении местно-распространённого рака молочной железы. Дис. канд. мед. наук. М., 1983.
- Fourquet A., Campana F., Scholl S. et al. Primary chemotherapy or primary radiotherapy: a possibility to preserve the breast in large tumors // International Congress of Radiation Oncology 1993, June 21-25. Kyoto. — 1993. — P. 112.
- Semiglazov V.F., Topuzov E.E., Bavli J.L., et al. Primary (neoadjuvant) chemotherapy and radiotherapy compared with primary radiotherapy alone in stage IIb-IIIa breast cancer // Ann. Oncol. — 1994. — Vol. — 5. — N 7. — P. 591-595.
- Shparik J. Breast cancer in 1980: meta-analysis of dose intensity (neoadjuvant chemotherapy) // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-10.
- Steger G.G., Barrios C., O`Shaughnessy J., et al. Review of capecitabine for the treatment of triple-negative early breast cancer. Cancer Research, 2010, v. 70, N 24, Suppl. 2, PD01-03.
- von Minckwitz G., Costa S.D., Raab G., Blohmer J.U., Eidtmann H., Hilfrich J., Merkle E., Jackisch C., Gademann G., Tulusan A.H., Eiermann W., Graf E., Kaufmann M. German Preoperative Adriamycin-Docetaxel and German Adjuvant Breast Cancer Study Groups. Dose-dense doxorubicin, docetaxel, and granulocyte colony-stimulating factor support with or without tamoxifen as preoperative therapy in patients with operable carcinoma of the breast: a randomized, controlled, open phase IIb study // J. Clin. Oncol. 2001. Vol. 19, N 15. P. 3506-3515.
- Smith I.C., Heys S.D., Hutcheon A.W. et al. Neoadjuvant chemotherapy in breast cancer: significantly enhanced response with docetaxel // J. Clin. Oncol. 2002. Vol. 20, N 6. P. 1456-1466.
- Hutcheon A.W., Heys S.D., Sarkar T.K. et al. Docetaxel primary chemotherapy in breast cancer: a five year update of the Aberdeen trial // Breast Cancer Res. Treat. 2003. Vol. 82, Suppl. 1. S9. Abstr. 11.
- Jackisch C., von Minckwitz G., Raab G. et al. Primary endpoint analysis of the Geparduo-study: preoperative chemotherapy (PCT) comparing dose-dense versus sequential adriamycin/docetaxel combination in operable breast cancer (T2-3, N0-2, M0) // Breast Cancer Res. Treat. 2002. Vol. 76. S90. Abstr. 152.
- Bear H.D., Anderson S., Brown A. et al. The effect on tumor response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide: preliminary results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27 // J. Clin. Oncol. 2003. Vol. 21. N 22. P. 4165-4174.
- Vriens B.E., Van de Vijver K.K., Boetes C. et al. Sequential versus upfront intensified neoadjuvant chemotherapy in patients with large resectable or locally advanced breast cancer (INTENS), first results from a phase III study of the Dutch breast cancer trialists` group (BOOG). 33 SABCS 2010, р1-11-10.
- Rouzier R, Perou CM, Symmans WF, et al. Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin Cancer Res. 2005;11(16):5678-5685.
- Cufer T., Pajk B., Borstnar S. Individualised systemic treatment. 5-th European breast cancer conference. Nice — France 21-25 March 2006. Abstract book. Abst. 237.
- V. Semiglazov, A. Kletsel, V. Semiglazov et al. Primary endocrine therapy vs chemotherapy in postmenopausal ER-positive breast cancer patients. 5-th European breast cancer conference. Nice — France 21-25 March 2006. Abstract book. Abst. 238.
- Hurley J, Doliny P, Reis I, et al. Docetaxel, cisplatin, and trastuzumab as primary systemic therapy for human epidermal growth factor receptor 2-positive locally advanced breast cancer. J Clin Oncol. 2006 Apr 20;24(12):1831-1838.
- AU Buzdar, V Valero, NK Ibrahim, et al. Neoadjuvant Therapy with Paclitaxel followed by 5-Fluorouracil, Epirubicin, and Cyclophosphamide Chemotherapy and Concurrent Trastuzumab in Human Epidermal Growth Factor Receptor 2—Positive Operable Breast Cancer: An Update of the Initial Randomized Study Population and Data of Additional Patients Treated with the Same Regimen Clinical Cancer Research 2007 13, 228-233.
- Han HS, Doliny P, Blaya M, et al. Dose-dense docetaxel, carboplatinum and trastuzumab as neoadjuvant therapy for human epidermal growth factor receptor-2 — positive stage II and III breast cancer. 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM . December 13–16, 2007. Breast Cancer Research and Treatment VOL. 106, Supplement 1, Abstr. 5060.
- Coudert BP, Arnould L, Moreau L, et al. Pre-operative systemic (neo-adjuvant) therapy with trastuzumab and docetaxel for HER2-overexpressing stage II or III breast cancer: results of a multicenter phase II trial. Ann Oncol. 2006 Mar;17(3):409-14.
- Untch M., Fasching P.A., Konacny G.E., et al. Pathological complete response after neoadjuvant chemotherapy + trastuzumab treatment predicts survival and detects a patient subgroup at high need for improvement of anti-HER2 therapy. Three year median follow-up data of the TECHNO trial. 33 SABCS 2010, P1-11-03.
- Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet. 2010;375(9712):377-84.
- Guitu S., Arnould L., Gauthier M., et al. Pathologic response and survival after neoadjuvant therapy for breast cancer: a 30-year sigle-center study. 33 SABCS 2010, Р1-11-02.
- Untch M., Loibl S., Bischoff J., et al. Lapatinib vs trastuzumab in combination with neoadjuvant antracycline-taxane-based chemotherapy: primary efficacy endpoint analysis of the GEPARQUINTO study (GBG 44). 33 SABCS 2010, S3-1.
- Baselga J., Bradbury I., Eidtmann H., et al. First results of the NeoALTTO trial (BIG 01-06/EGF 106903): a phase III, randomized, open label, neoadjuvant study of lapatinib, trastuzumab, and their combination plus paclitaxel in women with HER2-positive primary breast cancer. 33 SABCS 2010, S3-3.
- Gianni L., Pienkowski T., Im Y.-H. et al. Neoadjuvant pertuzumab (P) and trastuzumab (H): antitumor and safety analysis of a randomized phase II study (‘NeoSphere’). 33 SABCS 2010, S3-2.
- Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008 Mar 10;26(8):1275-81.
- 18. Rodenhuis S, Bontenbal M, van Hoesel QG, et al., Efficacy of high-dose alkylating chemotherapy in HER2/neu-negative breast cancer. Ann Oncol. 2006;17(4):588-596.
- Le Tourneau C, Dettwiler S, Laurence V, et al. 47% pathologic complete response rate to anthracyclinesbased associated with high cyclophosphamide doses neoadjuvant chemotherapy in basal-like and triple negative breast cancer patients. 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM . December 13–16, 2007. Breast Cancer Research and Treatment VOL. 106, Supplement 1, Abstr. 4010.
- von Minckwitz G., Eidtmann H., Rezai M., et al. Neoadjuvant chemotherapy with or without bevacizumab: primary efficacy endpoint analysis of the GEPARQUINTO study (GBG 44). 33 SABCS 2010, S4-6.
- Любченко Л.Н., Поспехова Н.И., Шабанов М.И. и др. Влияние герминальных мутаций гена BRCA 1 на фенотипическое проявление рака молочной железы. Тезисы IV Российской Онкологической Конференции Москва 21-23 ноября 2000. c.84-85.
- Chappuis P.O., Goffin J., Wong N., et al. A significant response to neoadjuvant chemotherapy in BRCA1/2 related breast cancer. J Med Genet. 2002; 39(8):608-610.
- Byrski T., Huzarski T., Dent R., et al. Response to neoadjuvant therapy with cisplatin in BRCA1-positive breast cancer patients. Breast Cancer Res Treat. 2009; 115(2):359-363.
- Byrski T., Gronwald J., Huzarski T., et al. Pathologic complete response rates in young women with BRCA1-positive breast cancers after neoadjuvant chemotherapy. J Clin Oncol. 2010; 28(3):375-379.
- Slamon DJ, Mackey J, Robert N, et al. Role of anthracycline-based therapy in the adjuvant treatment of breast cancer: efficacy analyses determined by molecular subtypes of the disease. // 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM. December 13–16, 2007. Breast Cancer Research and Treatment. — 2007. — VOL. — 106. —Suppl. 1. — Abst13.
- Portnoj S.M., Shiryaev S.V., Odjarova A.A., Anurova O.A., Laktionov K.P., Rjabchikov D.A. 99m Tc-MIBI elimination by a tumor as predictor of pathological effect of chemotherapy in locally advanced breast cancer patients. // 7th European Breast Cancer Conference. 24-27 March 2010, Barcelona, Spain. — EJC. — 2010. — V.8. -N 3, Suppl. -p.71.
- A.Goldhirsch, W.C.Wood, A.S.Coates et al. Strategy for subtypes — dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Annals of Oncology. 2011;22(8):1736-1747.
- Gazet JC, Coombes RC, Ford HT, et al. Assesssment of the effect of pretreatment with neoadjuvant therapy on primary breast cancer. Br J Cancer. 1996; 73(6):758-762.
- Mauriac L, Debled M, Durand M, Floquet A, Boulanger V, Dagada C, Trufflandier N, MacGrogan G. Neoadjuvant tamoxifen for hormone-sensitive non-metastatic breast carcinomas in earl y postmenopausal women. Ann Oncol. 2002 Feb;13(2):293-8.
- Eiermann W., Paepke S, Appfelstaedt J, Llombart-Cussac A, Eremin J, Vinholes J, Mauriac L, Ellis M, Lassus M, Chaudri-Ross HA, Dugan M, Borgs M; Letrozole Neo-Adjuvant Breast Cancer Study Group. Preoperative treatment of postmenopausal breast cancer patients with letrozole: A randomized double-blind multicenter study. Ann Oncol. 2001; 12 (11):1527-1532.
- V. Semiglazov, A. Kletsel, V. Semiglazov, E. Zhiltzova, V. Ivanov, G. Dashyan, A. Bozhok, O. Melnikova, R. Paltuev and L. Berstein. Exemestane (E) vs tamoxifen (T) as neoadjuvant endocrine therapy for postmenopausal women with ER+ breast cancer (T2N1—2, T3N0—1, T4N0M0). Journal of Clinical Oncology, 2005 ASCO Annual Meeting Proceedings. Vol 23, No 16S (June 1 Supplement), 2005: Abstr. 530.
- Smith I.E., Dowsett M, Ebbs SR, Dixon JM, Skene A, Blohmer JU, Ashley SE, Francis S, Boeddinghaus I, Walsh G; IMPACT Trialists Group. Neoadjuvant treatment of postmenopausal breast cancer with anastrozole, tamoxifen, or both in combination: the Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen (IMPACT) multicenter double-blind randomized trial. J Clin Oncol. 2005 Aug 1;23(22):5108-16.
- Cataliotti L, Buzdar AU, Noguchi S, Bines J, Takatsuka Y, Petrakova K, Dube P, de Oliveira CT. Comparison of anastrozole versus tamoxifen as preoperative therapy in postmenopausal women with hormone receptor-positive breast cancer: the Pre-Operative «Arimidex» Compared to Tamoxifen (PROACT) trial. Cancer. 2006 May 15;106(10):2095-103.
- Dixon J.M., Love CD, Bellamy CO, Cameron DA, Leonard RC, Smith H, Miller WR. Letrozole as primary medical therapy for locally advanced and large operable breast cancer. Breast Cancer Res Treat. 2001;66(3):191-199.
- Krainick-Strobel U.E., W. Lichtenegger, D.Wallwiener, et al. Neoadjuvant letrozole in postmenopausal estrogen and/or progesterone receptor positive breast cancer: A phase IIb/III trial to investigate optimal duration of preoperative endocrine therapy. BMC Cancer. 2008; 8: 62.
- Baselga J, Semiglazov V, van Dam P, Manikhas A, Bellet M, Mayordomo J, Campone M, Kubista E, Greil R, Bianchi G, Steinseifer J, Molloy B, Tokaji E, Gardner H, Phillips P, Stumm M, Lane HA, Dixon JM, Jonat W, Rugo HS. Phase II randomized study of neoadjuvant everolimus plus letrozole compared with placebo plus letrozole in patients with estrogen receptor-positive breast cancer. J Clin Oncol. 2009 ;27(16):2630-2637.
- Smith I. E., G. Walsh, A. Skene, et al. A Phase II Placebo-Controlled Trial of Neoadjuvant Anastrozole Alone or With Gefitinib in Early Breast Cancer. J Clin Oncology, 2007, 25, No 25,: pp. 3816-3822.
- Tubiana-Hulin M., Becette V, Bieche I, Mauriac L, Romieu G, Bibeau F, Macgrogan G, Bourgeois H, Chollet P, Defrance R, Spyratos F. Exemestane as neoadjuvant hormonotherapy for locally advanced breast cancer: results of a phase II trial. Anticancer Res. 2007;27(4C):2689-96.
- Mustacchi G., M. Mansutti, C. Sacco, et al. Neo-adjuvant exemestane in elderly patients with breast cancer: a phase II, multicentre, open-label, Italian study. Ann. Onc., April 1, 2009; 20(4): 655 — 659.
- Torrisi R., V Bagnardi, G Pruneri, et al. Antitumour and biological effects of letrozole and GnRH analogue as primary therapy in premenopausal women with ER and PgR positive locally advanced operable breast cancer. British Journal of Cancer (2007) 97, 802–808.
- McGuire WL. Steroid Receptors in Human Breast Cancer. Cancer Res. 1978, 38, 4289-4291.
- Wittliff JL. Steroid-hormone receptors in breast cancer. Cancer. 1984;53(3 Suppl):630-643.
- McGuire WL, Chamness GC, Fuqua SA. Estrogen receptor variants in clinical breast cancer. Mol Endocrinol. 1991;5(11):1571-1577.
- Elledge RM, Green S, Pugh R, Allred DC, Clark GM, Hill J, Ravdin P, Martino S, Osborne CK. Estrogen receptor (ER) and progesterone receptor (PgR), by ligand-binding assay compared with ER, PgR and pS2, by immuno-histochemistry in predicting response to tamoxifen in metastatic breast cancer: a Southwest Oncology Group Study. Int J Cancer. 2000;89(2):111-117.
- Semiglazov VF, Semiglazov VV, Dashyan GA, Ziltsova EK, Ivanov VG, Bozhok AA, Melnikova OA, Paltuev RM, Kletzel A, Berstein LM. Phase 2 randomized trial of primary endocrine therapy versus chemotherapy in postmenopausal patients with estrogen receptor-positive breast cancer. Cancer. 2007;110(2):244-54.
- Goldhirsch, J. N. Ingle, R. D. Gelber, et al. Thresholds for therapies: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2009. Ann Oncol. 2009;20 (8):1319-29.
- Bezwoda WR, Esser JD, Dansey R, Kessel I, Lange M. The value of estrogen and progesterone receptor determinations in advanced breast cancer. Estrogen receptor level but not progesterone receptor level correlates with response to tamoxifen. Cancer. 1991;68(4):867-72.
- Kaufmann M, von Minckwitz G, Bear HD, et al. Recommendations from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: new perspectives 2006. Ann Oncol. 2007;18(12):1927-34.
- Портной С.М., С.Н. Блохин, Х.С.Арсланов и др. Оценка онкологического риска одномоментных реконструктивных операций при раке молочной железы. Вопросы онкологии, 2008, № 6, 720-723.
- Д.В.Репетюк, С.М.Портной, В.Н.Богатырев, К.П.Лактионов Количественные цитологические факторы прогноза при раке молочной железы II и III стадий в оценке эффективности неоадъювантной химиотерапии. V съезд Ассоциации клинических цитологов. Москва, 2003. Программа и тезисы съезда. «Новости клинической цитологии России», 2003, том 7, №№ 1-2, тез. 37.
- Kuerer HM, Newman LA, Smith TL, et al. Clinical course of breast cancer patients with complete pathologic primary tumor and axillary lymph node response to doxorubicin-based neoadjuvant chemotherapy. J Clin Oncol. 1999;17(2):460-469.
- Untch M., Fasching P.A., Konacny G.E., et al. Pathological complete response after neoadjuvant chemotherapy + trastuzumab treatment predicts survival and detects a patient subgroup at high need for improvement of anti-HER2 therapy. Three year median follow-up data of the TECHNO trial. 33 SABCS 2010, P1-11-03.
- Cortazar P, Zhang L, Untch M, et al. Meta-analysis Results from the Collaborative Trials in Neoadjuvant Breast Cancer (CTNeoBC). 33 SABCS 2010 S1-11.
- Tokudome N., Ito Y., Takahashi S., et al. Triple negative or HER2 positive subtypes of breast cancer groups are chemo-sensitive, but higher rate of brain metastasis contributes poorer prognosis. 33 SABCS 2010, P1-11-13.
- Li S.P., Burcombe R., Beresford M.J., et al. Predicting outcome with Ki67 in primary breast cancer in the neoadjuvant setting. 33 SABCS 2010, PD07-04.
- Tanei T., Shimomura A., Shimazu K. et al. Prognostic significance of Ki67 index after neoadjuvant chemotherapy for human breast cancer. 33 SABCS 2010, Р1-11-19.
- Wada N., Asaga S., Yamauchi C., et al. Breast cancer patients with neoadjuvant chemotherapy have a different clinical significance of the Ki-67 expression before and after the treatment. 33 SABCS 2010, P3-10-28.


















