Проблема местного рецидива
Итак, органосохраняющее лечение имеет по сравнению с РМЭ равноценные результаты по общей выживаемости, но более высокую частоту местного рецидива (смотри таблицу 7). Целью органосохраняющего лечения является улучшение качества жизни, но возникновение местного рецидива рака в молочной железе для больной означает окончание комфортного состояния. Психологическая травма связана как собственно с возвратом заболевания, так и с последующей мастэктомией. Как предотвратить местный рецидив? С какими особенностями опухоли связано рецидивирование? Каковы оптимальные варианты хирургической техники, требования к лучевой терапии?
Наиболее известные факторы, влияющие на рецидивирование рака, приведены в таблице 8. К ним относятся молодой возраст, относительно большой размер опухоли, мультицентрический характер ее роста, распространенный внутрипротоковый компонент, наличие элементов опухоли по краю резекции, метастатическое поражение подмышечных лимфатических узлов, отсутствие лучевой терапии.
Таблица 8: факторы, повышающие вероятность местного рецидива
| Фактор | Частота местного рецидива и номер источника литературы |
| Размер опухоли > 2 см, по сравнению с <2 см | В 1,64 раза больше (57) |
| Мультицентрический рост | В 2,7 раза больше (58) |
| Распространенный внутрипротоковый рост | В 2.6 раза больше (58) в 4.1 раза больше (59) 0% при «негативных» краях (60) |
| «Позитивные» края резекции | 25% за 10 лет (60) В 3,8 раза выше, чем при «негативных» краях (60) 33-40% без буста; 4-12% с бустом 18-20 Гр (61) |
| Метастатическое поражение подмышечных лимфатических узлов | 46,5% против 29,2% без лучевой терапии за 10 лет (56) |
| Возраст до 35-40 лет | 19% (62) в 4.09-2.41 раза больше, чем в других возрастных группах (63) в 3,15 раза больше, чем в других возрастных группах (58); в 2,9 раза больше, чем в других возрастных группах (64); 17 — 8% при 10 летнем наблюдении (61) |
| Наследственный РМЖ | 30% при 10 летнем наблюдении (65) Равноценна с больными без отягощения наследственности (66) |
| Мутация BRCA1 или BRCA2 | ипсилатеральных — 49%, контралатеральных — 42% при 12 летнем наблюдении (67) |
| Отсутствие лучевой терапии | ~ в 3 раза повышается вероятность местного рецидива (56) |
Высокая частота местного рецидива в молочной железе после органосохраняющих операций с послеоперационным облучением характерна для больных моложе 35-40 лет. По данным J.M.Kurtz и соавт. (62), за 5 лет у больных до 40 лет местный рецидив развился в 19% случаев, а после 40 лет — в 9%. B.L. Fowble и соавт. (68) у пациенток до 35 лет наблюдали развитие местного рецидива в 40 % случаев, у 36-50-летних — в 16%, старше 50 лет — в 13% случаев (средняя длительность наблюдений — 4,6 года). P.Т.Neff и соавт. (69) при медиане прослеженности 5 лет отмечали развитие местного рецидива у 24% больных моложе 40 лет и 6 % пациенток старше 40 лет. J.M.Guenther и соавт. (70) подробно описали особенности операций у больных РМЖ Т1-Т2 в возрасте до 35 лет, лечение которых начиналось с выполнения секторальной резекции молочной железы с подмышечной лимфаденэктомией. В 54% случаев при микроскопии были обнаружены признаки инвазии краёв иссечённого сектора, что послужило поводом к повторному иссечению резецированного края (8%) и мастэктомии (23%). Ещё в 13% случаев отсроченная мастэктомия выполнена вследствие местного рецидива. В целом для больных в возрасте до 35 лет мастэктомия была необходима в 50% случаев, старше 35 лет — в 21%.
Частота наследственного РМЖ составляет по различным оценкам от 5 до 15% от всех случаев заболевания. Мутации BRCA1 и BRCA2 ответственны за 30-70 % случаев наследственного РМЖ (71). Мутации этих генов обуславливают чрезвычайно высокий риск развития второго РМЖ: BRCA1 — 64%, BRCA2 — 56% и рака яичников (72). Результаты органосохраняющих операций у носителей мутаций BRCA1\2 являются подтверждением первичной множественности опухолей у этих больных. При средней длительности прослеженности 12 лет частота рецидивов или вторых РМЖ после органосохраняющего лечения составила: ипсилатеральных — 49%, контралатеральных — 42% (67). Возможны два варианта лечебной тактики у больных РМЖ носителей мутаций BRCA1\2: в первом случае совмещается лечебная операция по поводу имеющегося рака с профилактической (модифицированная радикальная мастэктомия в сочетании с профилактическим удалением контралатеральной молочной железы ± двусторонняя реконструкция молочных желёз ± профилактическая аднексэктомия); во втором варианте на первом этапе выполняется только лечебная операция (например, органосохраняющая), пациентке разъясняются риски вторых раков, — РМЖ и рака яичников и возможности их профилактики.
Факторы, повышающие вероятность появления отдаленных метастазов
При анализе результатов органосохраняющих операций неизбежно возникает вопрос: действительно ли развитие местного рецидива в молочной железе не приводит к повышению риска диссеминации процесса и ухудшению общей выживаемости? V.V.Vishnyakova et al. (46), Veronesi U, et al. (52), B.Fisher et al. (48, 49), Объединённая группа исследователей раннего рака молочной железы (55) такого ухудшения не выявили. При возникновении рецидива своевременно выполненная мастэктомия или удаление рецидива с повторным облучением решали проблему для большинства больных. В результате показатели общей выживаемости групп пациенток статистически значимо не различались. С другой стороны, многофакторный анализ, при котором учитывалось развитие местного рецидива в молочной железе, свидетельствовал о достоверном повышении риска появления отдаленных метастазов и риска смерти этих больных по сравнению с больными без местного рецидива (смотри таблицу 9).
Таблица 9: относительный риск отдаленного метастазирования и смерти после возникновения местного рецидива.
| Источник | Относительный риск отдаленных метастазов у больных с местным рецидивом | Относительный риск смерти у больных с местным рецидивом |
| B.Fisher et al. (73) | 3,41 | |
| Whelan T. et al. (57) | 2,18 | 2,18 |
| H.Kemperman et al. (74) | 8,8 | |
| Elkhuizen PH et al. (63) | 4,90 | 4,29 |
| R. Rouzier et al. (75) | 5,34 | |
| Meric F et al. (76) | 6,2 | 5,5 |
| Komoike Y et al. (77) | 3,93 |
Возможна двоякая трактовка этих результатов: a) рецидивная опухоль является источником диссеминации опухоли, b) к началу лечения болезнь уже была диссеминирована, местный рецидив является только маркёром активности опухолевого процесса, следовательно, объём операции, проведение лучевой терапии не имеют значения для выживаемости больных (73). Как писали B.Fisher et al.: «Связь между местным рецидивом и отдаленным метастазированием не является причинной. Отдаленные метастазы возникают с равной частотой как у больных с органосохраняющей операцией, так и с мастэктомией. Местный рецидив — предсказатель риска, а не причина отдаленных метастазов» (73).
Такое заключение справедливо только для адекватных операций. Отсутствие опухоли по краю резекции — важнейший показатель адекватности органосохраняющей операции. Meric F и соавт. (76) было показано, что так называемые «позитивные» края резекции являются не только фактором, повышающим вероятность местного рецидива. У больных с «позитивными» краями в 3,7 раза повышается вероятность развития отдаленных метастазов и в 3,9 раза — вероятность смерти от РМЖ, по сравнению с больными, не имеющими элементов опухоли по краю резекции (смотри таблицу 10).
Еще один фактор, компрометирующий адекватность органосохраняющих операций, — наличие опухолевых клеток в перитуморальных сосудах (54). По нашим данным наличие этого фактора, особенно при отсутствии адъювантной химиотерапии, повышало вероятность развития отдаленных метастазов у больных после органосохраняющих операций. В случаях выполнения радикальных мастэктомий влияние этого фактора на прогноз отсутствовало.
C.J.H. van de Velde et al. (78) проводя мета-анализ клинического материала трех исследований EORTC (European Organization for Research and Treatment of Cancer, Европейской организации по исследованию и лечению рака), отметили, что выполнение органосохраняющих операций у пациенток моложе 35 лет сопровождается не только учащением местных рецидивов почти что в 3 раза (по сравнению с более старшими возрастными группами), но и снижением общей выживаемости по сравнению с больными этой возрастной группы, лечение которых было начато с РМЭ. Методом выбора для молодых женщин считают кожесохраняющую РМЭ с одномоментной реконструкцией.
Таблица 10: дополнительные факторы, повышающие вероятность диссеминации опухоли при органосохраняющих операциях
| Фактор | Относительный риск развития отдаленных метастазов при выполнении органосохраняющих операций (номер источника литературы) |
| Возраст до 35 лет | Более чем в 2 раза по сравнению с РМЭ (78). Тенденция к снижению безрецидивной выживаемости по сравнению с РМЭ (р=0,2230), без ухудшения общей выживаемости (наши данные) |
| «Позитивные» края резекции | В 3,7 раза больше (76) |
| Опухолевые клетки в перитуморальных сосудах | В 2,6 раза больше (54) |
| Отсутствие лучевой терапии | Повышение показателя 15-летней смертности от РМЖ на 5,1-7,1% (56) |
| Рецидив по типу отечно-инфильтративной формы рака | Развитие отдаленных метастазов в 15,1 чаще (79) Летальность в 7,8 раза больше (80) |
Мы проанализировали результаты лечения больных РМЖ T1-2N0M0 в возрасте до 35 лет по материалам РОНЦ им. Н.Н.Блохина РАМН. 40 больным были выполнены органосохраняющие операции с последующей лучевой терапией, а 37 больным — модифицированная радикальная мастэктомия. Длительность прослеженности более 10 лет. Показатели общей выживаемости были одинаковы. Безрецидивная выживаемость больных с органосохраняющими операциями имела тенденцию к снижению по сравнению со второй группой больных, однако различия не были статистически значимы, р=0,223. Таким образом, на нашем, относительно небольшом материале, не прослеживается негативного влияния на отдалённые результаты факта выполнения органосохраняющих операций у женщин молодого возраста.
Некоторые технические решения при органосохраняющих операциях
Интраоперационная оценка состояния краёв резекции
Для достижения «чистых» краёв резекции принято выполнять повторные операции (ререзекции или мастэктомии) в тех случаях, когда при плановом гистологическом исследовании получают данные о наличии элементов инвазивного рака или внутрипротокового компонента опухоли по краю удаленного препарата. Частота таких повторных операций может достигать 1/3 (39% по N.Q. Mirza и соавт. [81]).
Возможно ли решить проблему «чистых» краёв резекции интраоперационно по результатам срочного гистологического исследования? Мы проанализировали эффективность такого подхода на нашем материале (82). В период с 2003 по 2008 гг. в хирургическом отделении опухолей женской репродуктивной системы (заведующий отделением проф. К.П.Лактионов) РОНЦ им. Н.Н.Блохина РАМН 145 больных раком молочной железы T1-3N0-3M0 были оперированы с интраоперационным гистологическим исследованием резецированной ткани молочной железы. Кроме уточнения гистологического типа новообразования, оценивались наличие и протяженность внутрипротокового компонента, наличие множественности зачатков опухолевого роста в пределах удаленного образца, а также определялось расстояние от границы опухоли до края резекции и собственно состояние краёв резекции. У 48 больных (34%) первоначальный план органосохраняющей операции был модифицирован из-за интраоперационных морфологических находок: в 33 случаях (23%) дополнительно иссекались пластинки ткани железы, в 15 случаях (11%) была выполнена мастэктомия. Основанием для выполнения ререзекции было обнаружение по линии разреза инвазивной опухоли или протокового рака in situ на ограниченном участке, для мастэктомии — невозможность выполнения органосохраняющей операции с «чистыми» краями резекции и/или мультицентрического характера роста.
При плановом изучении гистологических препаратов у 9 пациентов (7%) в краях резекции были выявлены элементы опухолевого роста, не обнаруженные при интраоперационном исследовании. Двум из этих больных была в дальнейшем выполнена мастэктомия, 7 проводилась лучевая терапия с использованием буста на ложе опухоли. Все больные в дальнейшем получали системное адъювантное лечение. При выполнении органосохраняющей операции обязательно проводилась лучевая терапия на молочную железу в СОД 46-52 Гр.
Средняя длительность прослеженности составила 46,0±2,0 месяцев (от 3 до 8 лет). После органосохраняющих операций местный рецидив (за который принималось повторное развитие опухоли в любом отделе оперированной молочной железы) развился у 3 больных (2,4% или 0,6% в год). По рекомендациям Европейского общества мастологов (EUSOMA) частота местных рецидивов в молочной железе после органосохраняющих операций не должна превышать 2% в год (83). В нашей работе удалось продемонстрировать выраженные положительные моменты от применения интраоперационного гистологического исследования при выполнении органосохраняющих вмешательств. Практически та же названная выше 1/3 больных нуждалась в изменении первоначально запланированного объёма операции и, благодаря результатам срочного гистологического исследования, это могло быть сделано сразу. Таким образом, удалось, и сделать более редкой необходимость выполнения отсроченных операций, и добиться невысокой частоты местных рецидивов.
Сходные результаты были получены в работе T.P.Olson с соавт. (84): 290 больным была произведена лампэктомия со срочным гистологическим исследованием краёв удаленного препарата, из них 70 (~1/4) по результатам этого анализа была выполнена дополнительная резекция во время операции. По результатам планового гистологического исследования отсроченную ререзекцию молочной железы выполнили 16 больным и ещё 17 больным — мастэктомию. При средней длительности прослеженности 53 месяца местный рецидив наблюдали у 6 больных (2,7% или 0,6% в год). В литературе нами обнаружено и описание еще более низкой частоты местного рецидивирования — пятилетняя выживаемость без местного рецидива 99%, или частота рецидива 0, 2% в год (85). Авторы этого исследования также отмечают очевидную пользу интраоперационного гистологического исследования краёв резекции; по их данным расширение объёма операции было необходимо в ¼ случаев.
Каков должен быть запас «чистых краёв» резекции? Вопрос, которому посвящено огромное количество исследований. На наш взгляд, наилучшее резюме содержится в рекомендациях EUSOMA: хирург при выполнении операции должен стремиться иметь расстояние 1 см от края опухоли до края резекции, но показанием к повторной операции является наличие инвазивного или внутрипротокового рака по краю резекции (83).
Техника радикальной резекции
Под радикальной резекцией понимается органосохраняющая операция, разработанная В.В.Вишняковой (45). Операция выполняется при латеральных локализациях небольших (до 3 см) опухолей, заключается в клиновидном иссечении 1/3-1/4 объёма молочной железы, включающего опухоль, единым блоком с кожей, фасцией большой грудной мышцы и клетчаткой I-III уровней по Berg (смотри рисунок 7). Валентина Васильевна негативно относится к тому, что другие органосохраняющие операции, отличающиеся по технике исполнения, называют термином «радикальная резекция». Мы, конечно, придерживаемся авторской трактовки описания операции и её названия.
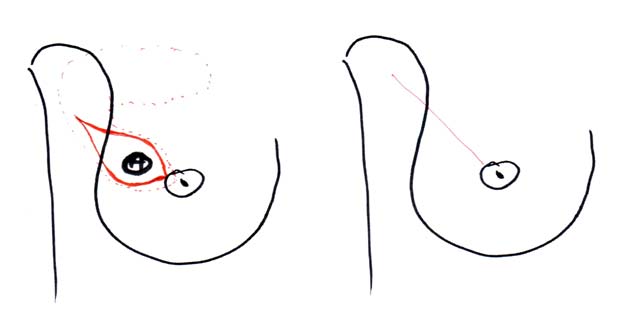
Рисунок 7. Радикальная резекция.
Пионерский вариант операции доказал возможность адекватного лечения больных с сохранением органа и создал базу для её совершенствования. Совершенствование было необходимо в связи с недостаточной косметичностью операции. По нашим данным, удовлетворительный косметический эффект после радикальной резекции наблюдался у 1/3 больных, основными проблемами были дефицит объёма и деформация железы (86).
Можно сказать, что органосохраняющие операции первого этапа (парциальная мастэктомия, квадрантэктомия, радикальная резекция) в их первоначальном виде (широкие клиновидные резекции без дополнительного восстановления формы железы) ушли в прошлое. Современные органосохраняющие операции это лампэктомия и онкопластическая резекция.
Техника лампэктомии.
Лампэктомия (lump — глыба, кусок, комок), была разработана в ходе исследований Национального проекта дополнения операций на молочной железе и кишечнике (США, NSABBP, 48). При такой операции выполняли удаление опухоли через дугообразный кожный разрез, ориентированный по кожным складкам, иссечение кожи и подлежащей фасции было не обязательным, запас здоровых тканей железы не регламентировался. Ушивание ткани железы также считалось ненужным (смотри рисунки 8 и 9).
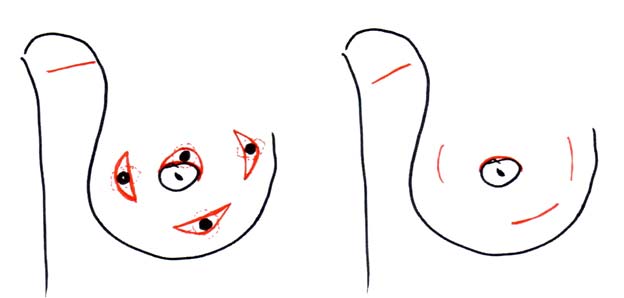
Рисунок 8. Разрезы при лампэктомии с иссечением кожи над опухолью
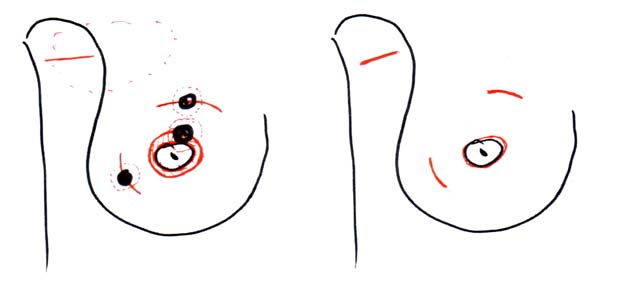
Рисунок 9. Разрезы при лампэктомии без иссечения кожи над опухолью
Обретя собственный опыт в выполнении лампэктомии, мы пришли к необходимости её модифицировать. Модификация касается двух моментов: опухоль удаляется обязательно с запасом здоровых тканей вокруг неё, обязательно производится ушивание ткани железы. Иссекать или не иссекать кожу над опухолью? Если опухоль выходит за пределы капсулы железы в подкожную клетчатку, — иссекать. Мы не сохраняем кожу над опухолью в случаях, когда имеется втяжение кожи над ней. Для опухолей небольшого размера (до 1-2 см) лампэктомия остаётся лучшей операцией: нетравматичной и элегантной.
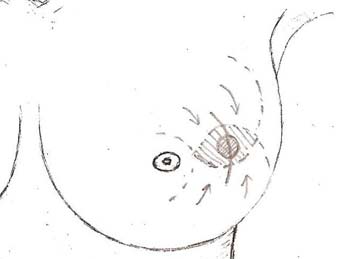
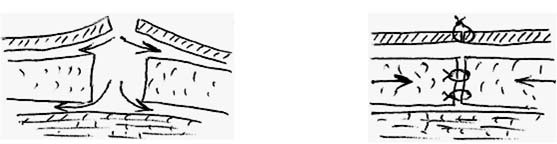
Рисунок 10. Техника лампэктомии. Дугообразный кожный разрез, иссечение сектора ткани радиальной ориентации, отсепаровка кожи, мобилизация железистой ткани, послойное ушивание.
При больших размерах опухоли или при её центральной локализации для сохранения формы железы возникает необходимость в привлечении дополнительных усилий по перемещению тканей, и\или вмешательства на контралатеральной железе для сохранения симметрии, то есть необходимость в выполнении онкопластических резекций.
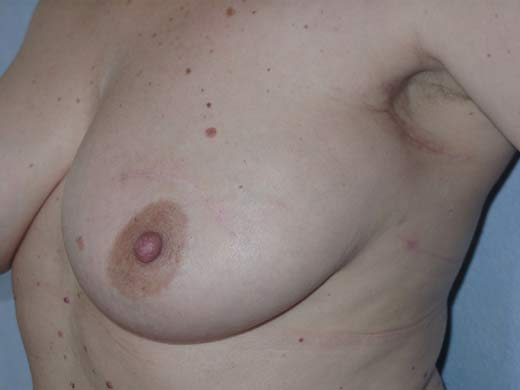
Рисунок 11. Вид больной через 1 год после лампэктомии.


















